Учебно-исследовательская работа студента (УИРС): Активность трансаминазы сыворотки крови на этапах восстановления после экспериментального токсического гепатита
Актуальность исследования. Для современного человека стало привычно жить в обстановке токсической напряженности, обусловленной экологическими и технологическими катастрофами, профессиональными вредностями, несчастными случаями в быту. Около 6 млн. наименований химических соединений, накопленных в окружающей среде, представляют потенциальную опасность для здоровья населения (Лужников, 1994).
Дата добавления на сайт: 20 мая 2024
Введение
Актуальность исследования. Для современного человека стало привычно жить в обстановке токсической напряженности, обусловленной экологическими и технологическими катастрофами, профессиональными вредностями, несчастными случаями в быту. Около 6 млн. наименований химических соединений, накопленных в окружающей среде, представляют потенциальную опасность для здоровья населения (Лужников, 1994).
Наибольшую часть из химических соединений, накопленных в окружающей среде, занимают хлорорганические вещества.
Четыреххлористый углерод относится к хлорпроизводным метана. Это бесцветная жидкость с ароматическим запахом. Он широко используется в промышленности как растворитель масел, жиров, каучука (Лужников, 1989), в производстве огнетушителей. Является «прямым» гепатотоксином и широко применяется в экспериментальной медицине. Клиническая картина отравления включает в себя симптомы повреждения печени и почек (Блюгер, 1984). Печень принимает большое участие в процессах, которые обеспечивают постоянство концентрации питательных веществ в крови (Рапопорт, 1966). Печень является «центральной лабораторией организма», где осуществляются почти все процессы метаболизма и синтез жизненно важных веществ.
В печени постоянно идут процессы образования, инактивации и обезвреживания продуктов метаболизма и бактериальных, токсических веществ, образующихся и поступающих в организм из внешней среды (Абдуллаев, Каримов, 1989).
Наиболее специфическим признаком заболевания печени является повышение активности аланинаминотрансферазы (АлАТ).
При помощи храмотографии выделяют два изофермента, в нормальной сыворотке обе изоформы АлАТ представлены в равных количествах. В печеночной ткани обнаруживается почти исключительно одна из изоформ, активность которой возрастает в сыворотке крови при заболевании печени (Вилкенсон, 1981).
Широкое распространение и высокая активность аминотрансфераз в органах и тканях человека, а также сравнительно низкие величины активности этих ферментов в крови послужили основанием для определения уровня ряда аминотрансфераз в сыворотке крови человека при органических и функциональных поражениях печени. (Березов, Коровкин, 1998).
Лечение больных с острыми и токсическими поражениями печени, несмотря на прогресс современной гепатологии все еще остается крайне сложным. Поэтому актуален поиск новых веществ обладающих гепатопротекторными свойствами (Колпаков и др., 2001).
При этом большое внимание уделяется естественным природным метаболитам, которые могут быть использованы как средства для профилактики и коррекции токсических поражений печени (Проскурякова, 1995).
Установлен выраженный фармакотерапевтический эффект фитоэкстрактов при экспериментальном гепатите, вызванном четыреххлористым углеродом (Акцупов, 1984).
В состав желчегонных гепатозащитных растительных препаратов входят фенольные соединения, часть которых представлена оксикоричными кислотами и их гидропроизводными, обладающими высокой антиоксидантной и мембраностабилизирующей активностью (Сальникова и др., 1989).
Среди природных гепатопротекторов особо выделяется портулак огородный.
Как лекарственное растение портулак огородный (Portulaca oleracea) широко использовался в народной медицине еще во времена Гиппократа (Махлюк, 1993).
Портулак огородный употребляется в народной медицине для лечения заболеваний печени (Лавренов, Лавренова, 1999), при гипотонии и сахарном диабете (Блинков, 1983).
Систематическое использование портулака огородного в пищу снижает содержание холестерина, уменьшает проявление симптомов атеросклероза. Лекарственным сырьем служат стебли и листья, также семена.
Наибольшую активность оказывает сок. Свежее растение и препараты из него обладают противовоспалительным, мочегонным, желчегонным, легким сахаропонижающим действиями.
Свежий сок портулака показан при воспалительных заболеваниях почек, печени и слизистой оболочки мочевого пузыря. Он является антитоксическим средством по отношению к ядам змей и насекомых (Зимин, 1992).
Цель и задачи исследования. Целью нашей работы явилось исследование активности аланинаминотрансферазы в сыворотке крови кроликов при однократном введении четыреххлористого углерода и процессе лечения с использованием традиционных и нетрадиционных методов детоксикации организма. Для этого были поставлены следующие задачи:
Определить активность АлАТ в сыворотке крови кроликов при однократном введении четыреххлористого углерода (2мл на I кг веса) и в течение 10 дней после отравления.
Определить активность АлАТ в сыворотке крови кроликов при однократном введении четыреххлористого углерода и традиционном лечении витаминами (Bt, В2, В6, В|2, С, Е, РР) в течение 10 дней.
Определить активность АлАТ в сыворотке крови кроликов при однократном введении четыреххлористого углерода в сочетании с приемом внутрь сока портулака огородного.
Определить активность АлАТ в сыворотке крови кроликов при однократном введении четыреххлористого углерода и комбинированном лечении комплексом витаминов и соком портулака огородного.
Научная новизна работы. Установлено, что при совместном лечении витаминами и портулаком огородным, активность аланинаминотрансферазы восстанавливается на пятый день после токсического поражения.
Глава I. Обзор литературы
1.1 Биохимические механизмы токсического поражения организма четыреххлористым углеродом (CCL4).
Четыреххлористый углерод (CCL4) является «прямым» гепатотоксином и широко применяется в экспериментальной медицине в качестве классического гепатотоксического агента (Блюгер, 1984). Он относится к хлорпроизводным метана. Это бесцветная жидкость с ароматическим запахом, молекулярная масса 153,81, хорошо растворим в жирах (Лужников, 1989).
Четыреххлористый углерод попадает в организм случайно или в результате приема с суисцидальной целью (Шерлон, Дули, 1999), через поврежденную кожу и органы дыхания (Подымова, 1993). Отравление происходит при вдыхании паров CCL4 в плохо вентилируемых помещениях (Блюгер, 1989).
Уже в первый день возможны симптомы острого отравления (Подымова, 1993).
Выделяют три степени тяжести отравления четыреххлористым углеродом:
I. Легкая степень характеризуется практическим отсутствием клинических признаков токсического поражения печени. Нарушение её функции выявляется только лабораторным методом исследования, при которых установлено повышение содержания аланин- и аспартатаминотрансфераз , фруктозодифосфатальдолазы, фруктозомонофосфатальдолазы, лактатдегидрогеназы - ЛДГ (общей) и ЛДГ5, при радиоизотопном исследовании - нарушение гемодинамики печени.
П. При токсическом поражении печени средней степени тяжести наблюдаются клинические признаки её нарушения (увеличение, болезненность при пальпации, печеночная колика, желтуха, явление геморрагического диатеза) в сочетании с более выраженными изменениями показателей лабораторного метода исследования: в частности, отмечалось повышение активности цитоплазматических ферментов, уменьшение содержания Р -липопротеидов, холестерина, гипопротеинемия, при радиоизотопном исследовании - нарушении гемодинамики печени и её поглотительной функции при всех видах интоксикации и снижение выделительной функции при остром отравлении дихлорэтаном и четыреххлористым углеродом.
III.Тяжелая степень поражения печени характеризуется развитием синдрома печеночной энцефалопатии, желтухой, увеличением печени; при лабораторных исследованиях отмечалось высокое содержание в сыворотке крови ЛДГ4_5 и малатдегидрогеназы - МДГ3, появление дополнительной фракции МДГ4, повышение активности глутаматдегидрогеназы, угнетениеактивности псевдохолинэстеразы, снижение уровня Р - липопротеидов, холестерина, фосфолипидов, при радиоизотопном исследовании - одновременно с нарушением гемодинамики, выраженные изменения поглотительно-выделительной функции печени. (Лужников, Шиманко, 1980). Четыреххлористый углерод оказывает наркотическое действие на ЦНС, вызывает поражение паренхиматозных органов - печени, почек (Лужников, 1984; Подымова, 1993).
На 2 - 3-й сутки после отравления, как правило, развиваются клинические признаки токсической дистрофии печени. Часто развивается геморрагический синдром, проявляющийся кровоизлияниями под конъюнктиву, носовым и желудочно-кишечными кровотечениями.
Нарушения свертывающей системы крови проявляются в первые сутки повышением уровня фибриногена крови и фибринолитической активности.
У всех больных с отравлением четыреххлористым углеродом имеются нарушения функций почек различной степени, в 85% развивается острая почечная недостаточность (ОПН) с олигоурией и азотемией. (Лужников, 1994).
Метаболические превращения четыреххлористого углерода являются основой его гепатотоксического действия, которое происходит в мембранах эндоплазматического ретикулума печени при участии цитохрома Р - 450 (Лужников, 1994).
В прямой интоксикации существенную роль играет избыточное образование свободных радикалов, присутствие которых обычно обнаруживает в составе желчи. Повреждающее клетки действие свободных радикалов опосредуют такие факторы, как активация фосфолипазы А, накопление лизофосфатидов, активация регенерирующего поли-АДФ-рибополимеразу фермента окислительной модификации ДНК, понижением содержания NAD и АДФ (Feher, Vereckei, Lengyel, 1995).
Также свободные радикалы вызывают разрушение субклеточных структур, содержащих липиды и липопротеиды, вследствие образования перекисей липидов (Дубинина,2006).
О поражении клеточной мембраны можно судить по понижению электрофоретической подвижности печеночных клеток.
Инициирование перекисного окисления липидов (ПОЛ) биомембран является типовым патогенетическим механизмом при заболеваниях печени различной этиологии. При токсическом поражении печени хлорированными углеводородами, инициирование ПОЛ является одним из начальных механизмов нарушения проницаемости мембран гепатоцитов и их альтерации (Виноградова, Харлицкая, 1989).
Важную роль в возникновении обратимых ультраструктурных нарушений различных типов клеток при развитии в них патологических изменений связывают с образованием пор в мембранах под влиянием ПОЛ и аккумуляцией клетками ионов кальция (Бондарева, Немова, Кяйвяряйнен, 2006; Виноградова и др. 1989).
Образование пор в мембранах лизосом открывает доступ для выхода их ферментов в цитозоль после воздействия четыреххлористого углерода, и видимо, приводит к необратимым изменениям и гибели гепатоцитов (Вакулин, 1989).
Также под воздействием высоких доз четыреххлористого углерода происходит быстрая дезагрегация рибосом до мономеров (Подобед, Федорова, 1995), увеличение размеров митохондрий вследствие их набухания, дезорганизация и уменьшение количества митохондриальных крист, одновременно с изменениями митохондрий происходит увеличение числа первичных лизосом, локализованных в основном вокруг пластичного комплекса Гольджи. В большинстве гепатоцитов происходит редукция гранулярного эндоплазматического ретикулума (Проскурякова, 1995; Абдуллаев, Каримов, 1989).
Выраженность изменений эндоплазматического ретикулума и митохондрий в различных гепатацитах в пределах печеночной дольки при остром отравлении четыреххлористым углеродом зависит от степени метаболической активности микросомальных энзимов в каждом гепатоците. Степень активации определяется структурно-функциональными особенностями этих гепатоцитов в печени интактных животных. Изменения популяции митохондрий в каждом гепатоците в значительной степени обусловлены степенью повреждения эндоплазматического ретикулума. Различная повреждаемость гепатоцитов четыреххлористым углеродом предполагает возможность восстановления функций части поврежденных гепатоцитов за счет процессов внутриклеточной репаративной регенерации (Шкурупий, 1973).
Показано, что после воздействия четыреххлористого углерода масса гепатоцитов, а следовательно и печени, возрастает в основном за счет полиплоидизации клеток при их невысокой пролиферативной активности и снижения процентного содержания двуядерных гепатоцитов. Проскурякова считает, что такие изменения популяции гепатоцитов способствуют преждевременному старению органа, поскольку не происходит естественное восстановление исходного количества клеток (Проскурякова, 1995).
Известно, что при токсических и хронических повреждениях печени наблюдается угнетение синтеза белка. Белковая недостаточность и дефицит незаменимых аминокислот в свою очередь приводят к снижению иммунного статуса организма (Хныченко и др., 2000).
Нарушения углеводного обмена при поражении печени могут сопровождаться явлениями как гипо- так и гипергликемии.
Установлено значительное снижение уровня гликогена в печени. При этом большое значение имеет развивающаяся гипоксия с преобладанием анаэробного гликолиза в печеночной ткани, уменьшением синтеза АТФ и возникает дефицит НАД-Н2 и НАДФ-Н2.
О нарушении углеводного обмена свидетельствуют также существенные изменения промежуточного обмена углеводов, прежде всего содержание молочной и пировиноградной кислот в крови.
При отравлении хлороформом и четыреххлористым углеродом поглощение кислорода печеночной тканью уменьшается.
Понижение тканевого дыхания на срезах печени и снижение дыхательного коэффициента было обнаружено Н.Х. Абдуллаевым (, 1968) при введении животным гелиотрина и четыреххлористого углерода. По мнению автора, эти изменения свидетельствуют о нарушении окислительных процессов в результате угнетения активности дыхательных ферментов и накопления недоокисленных продуктов обмена в тканях печени.
Нарушения дыхания и окислительного фосфорилирования при введении гепатотоксических веществ, происходят на уровне дыхательной цепи. Так, В.М. Мишин (1972) через 24 ч. после отравления крыс четыреххлористым углеродом отметил полное разобщение дыхания и окислительного фосфорилирования митохондрий в результате потери на участке дыхательной цепи одного из переносчиков электронов - цитохрома с (Абдуллаев, Каримов, 1989).
При хронических воздействиях малыми дозами четыреххлористого углерода гистологические изменения в печени выражаются в появлении мутного набухания, мелко - и крупнокапельного ожирения.
На начальном этапе, в течение суток после отравления животных большими дозами четыреххлористого углерода (от 0,6 мл на 100 г), выявляются в основном циркуляторные расстройства в виде расширения синусоидов и портальных капилляров с одновременным набуханием эндотелия и расширения пространств Диссе.
Таким образом, для отравления большими дозами гепатотоксических агентов характерны выраженные нарушения белкового, углеводного и фосфолипидного обмена, снижение содержание витамина С и повышение гидроксипролина, а также изменение системы «гистамин-гистаминаза» (Абдуллаев, Каримов, 1989).
Для диагностики поражений печени важное значение приобретают исследования топографии ферментов не только в органах, но и в клетках, где они локализованы раздельно и связаны с определенными клеточными структурами (Лужников, Костомарова, 1989).
1.2 Значение антиоксидантных свойств витаминов при лечении токсических поражений организма
Пероксидазный эффект гепатотропных ядов в значительной степени определяет патогенез их повреждающего действия на печень, поэтому в качестве гепатопропекторов широко применяют антиоксиданты (Венгеровский, Саратиков, 1988).
Ведущим звеном в гепатозащитном действии изучаемых антиоксидантов является их свойство ингибировать перекисное окисление липидов (ПОЛ). Подавляя этот процесс, они тормозят образование свободных радикалов и продуктов перекисного окисления липидов в гепатоцитах и связанное с этим нарушение проницаемости клеточных мембран. Кроме того, они предупреждают солюбилизацию мембранных ферментов и инактивацию ферментов, обеспечивающих высокий уровень обмена веществ, энергии и функционального состояния печени (Скакун, Ковальчук, 1987).
К антиоксидантам относятся витамины, флавоноиды, тиолы и др. (Венгеровский, Саратиков, 1988). Для восстановления функций печени после токсических поражений используют витамины: В,, В2, В6, В12, С, Е, РР.
Одной из распространенных гипотез о биологической роли витамина Е является представление об антиоксидантном механизме его действия (Куница, Кузьменко, 1993).
Витамин Е (а - токоферол) тормозит накопление диеновых конъюгантов и малонового диальдегида, сохраняет ненасыщенные связи жирных кислот, повышает содержание восстановленного глутатиона и отношение SH / SS-групп в мембранах печени при экспериментальной патологии, вызванной четыреххлористым углеродом (Венгеровский, Саратиков, 1988).
Витамин Е предохраняет окисление биологических систем перекисями жиров. Предохранение окисления полиненасыщенных жирных кислот витамином Е или антиоксидантами происходит путем прерывания радикальной цепной реакции. (Букин, 1982).
Существует прямая связь между витамином Е и тканевым дыханием и, обратная связь, между этим витамином и степенью окисления липидов. Токоферолы разрушают реактивные формы кислорода (Березов, Коровкин, 1998).
Роль витамина Е как ингибитора свободно-радикального окисления велика в процессе перекисного окисления липида скелетных мышц (Надиров, 1981).
Тиамин и его производные широко применяются в клинике при лечении сердечно-сосудистой и эндокринной систем, различных по этиологии поражений печени, инфекционных заболеваний. В развитии многих из указанных патологических процессов существенную роль играют иммунологические механизмы. Проведенные эксперименты показали, что введение тиамина из расчета 100 мкг на 100г веса тела, стимулирует формирование иммунного ответа у здоровых и отравленных четыреххлористым углеродом крыс, причем стимулирующий эффект тиамина у отравленных животных был выражен сильнее, чем у здоровых (Прокопенко, Конопля, 1978).
Витамин В, в форме тиаминпирофосфата является составной частью минимум 5 ферментов, участвующих в промежуточном обмене веществ. Тиаминпирофосфат входит в состав двух сложных ферментных систем -пируват - и а - кетоглутаратдегидрогеназных комплексов, катализирующих окислительное декарбоксилирование пировиноградной и а-кетоглутаровой кислот. В составе транскетолазы тиаминпирофосфат участвует в переносе гликоальдегидного радикала от кетосахаров на альдосахара (Березов, Коровкин, 1998).
Пиридоксальфосфат - коферментная форма витамина В6, является представителем новой группы высокоэффективных лекарственных средств -препаратов метаболической терапии. Его успешно применяют у больных хроническим гепатитом и циррозом печени. Введение пиридоксальфосфата при токсическом гепатите, вызванном введением четыреххлористого углерода, приводит к ассоциации молекул АсАТ в крови с образованием менее активных ассоциатов (Ковлер, Павленко и др., 1986).
Пиридоксальфосфат является простетической группой аминотрансфераз, катализирующих обратимый перенос аминогруппы от аминокислот на а - кетокислоту и декарбоксилаз аминокислот, осуществляющих необратимое отщепление углекислого газа (С02) от карбоксильной группы аминокислот с образованием биогенных аминов (Березов, Коровкин, 1998).
При лечении токсических поражений печени рибофлавином (витамин В2) полностью восстанавливается электролитный состав фракции крови, содержание электролитов в печени остается сниженным (Якушева, 1991).
Коррекция содержания электролитов в стенке кровеносных сосудов при лечении токсического гепатита рибофлавином связана с антиоксидантными свойствами препарата, что приводит к нормализации мембранного транспорта и трофического обеспечения органа, ускорению процессов регенерации, улучшению морфологической картины, функционального состояния печени, кровообращения в органе и в организме в целом (Якушева, 1986).
Основные биохимические функции кобаламина (витамин В,2)
заключается в изомеризации L-глютаминовой кислоты в L-трио-р1-метиласпарагиновую, метилмалонилкофермента А, превращения глицерина в (3-оксипралиновый альдегид, лизина в маслянную или уксусную кислот. (Овчинников, 1987).
При недостаточности витамина В12 наблюдается пернициозная анемия, болезнь Бирмера-Аддисона, характеризуется тяжелым нарушением кровотворения, недостаточной секреции желудочного сока и поражениями НС.
Мукопротеиды, содержащиеся в желудочном соке, обладают способностью связывать коболамин и способствовать его всасыванию через слизистую оболочку кишечника. Лишь небольшая часть витамина может усваиваться в свободном виде путем простой диффузии. В плазме коболамин связывается с белками (Рапопорт, 1966).
Витамин С участвует в окислительно-восстановительных процессах, в реакциях гидроксилирования коллагена, синтезе гормонов коры надпочечников (кортикостероидов), аминокислот триптофана и др. (Березов, Коровкин, 1988).
Витамин С занимает прочное место в арсенале средств, принимаемых при заболеваниях печени. Он активируя окислительные процессы, оказывает положительное влияние на синтетические и другие реакции в углеводном, белковом, жировом, а самое главное - энергетическом обмене. Это положительно отражается на морфофункциональных особенностях тканей, органов, в том числе и на печени (Абдуллаев, Каримов, 1989).
Витамин РР (никотиновая кислота) входит в состав НАД или НАДФ, являющихся коферментом большого числа обратимо действующих в окислительно-восстановительных реакциях дегидрогеназ.
Ряд дегидрогеназ используют только НАД и НАДФ (малатдегидрогеназа и глюкозо-6-фосфатдегидрогеназа) другие могут катализировать окислительно-восстановительные реакции в присутствии любого из них (Березов, Коровкин, 1998).
Витамин РР обладает специфическим сосудорасширяющим действием (Рапопорт, 1966), широко распространен в растительных продуктах может образовываться из триптофана- из 60 молекул триптофана может образоваться одна молекула никотинамида (Северин,2003)
1.3 Клинико-диагностическое значение определения активности аминотрансфераз
С тех пор как в середине 50-х годов было обнаружено повышение активности аминотрансфераз в крови больных, большие надежды стали возлагать на определение уровня ферментов в сыворотке крови как на более специфический показатель. Очевидно, что выход ферментов из гепатоцитов должен быть тем значительнее, чем больше масса пораженной ткани. При этом имеют значение уровень содержания данного фермента в тканях печени, а также динамика его нарастания в крови. Возможно, дело не ограничивается простым «вымыванием» ферментов в кровь, так как повышение активности различных ферментов происходит не одновременно (Неверов, 1990).
К настоящему времени известно 20 основных энзимов, содержащихся в миокарде: альдолаза, -глутамилтранспептидаза, лактатдегидрогеназа (ЛДГ), пируваткиназа и др. Однако о «кардиоспецифичности» многих из них можно говорить лишь весьма условно. Так, один из наиболее часто определяемых энзимов – аспартатаминотрансфераза (АсАТ) обнаруживает повышенную активность у 97-98% больных с трансмуральным инфарктом миокарда. Гиперферментемия обычно наступает через 6-12 ч от начала болевого приступа, достигает пика в течение вторых суток и исчезает на 4-7-й день болезни. Однако этот показатель возрастает также при заболеваниях печени, желчевыводящих путей, поджелудочной железы, при расслаивающей аневризме аорты, тромбоэмболии легочной артерии (у 25-50% больных), мозговом инсульте, инфаркте почек, при травмах и заболеваниях скелетной мускулатуры (мышечная дистрофия, дерматомиозит и др.), а также при различных хирургических вмешательствах (у 95% больных). Повышение активности аспартатаминотрансферазы наблюдается и при различных заболеваниях сердца - миокардитах, перикардитах и даже при катетеризации сердца. Повышение активности энзима описано при тяжелой декомпенсации сердца и после длительных пароксизмов тахикардии; в этих ситуациях его связывают с застоем крови в печени. Значительный подъем активности фермента наблюдается у больных с патологией желчных путей, получавших инъекции морфина (Mетелица, 1996). Гиперферментемия возникает приблизительно у 11% женщин, использующих таблетированные контрацептивные средства, и у 80% лиц, принимающих клофибрат и отмечающих связанные с ним мышечные боли.
Повышенная активность аминотрансфераз может наблюдаться как в сочетании с постконверсионными изменениями сегмента ST и зубца Т, так и без них. Эти биохимические сдвиги могут быть связаны и с воздействием разряда дефибриллятора на скелетную мускулатуру грудной м клетки.
Наряду с аминотрансферазами в клинической практике используется определение активности лактатдегидрогеназы и ее «сердечного» изоэнзима (-лактатдегидрогеназа или «первая фракция»), -гидробутиратдегидрогеназы (ГБДГ), креатинфосфокиназы и ее «сердечного» изоэнзима МВ креатинфосфокиназы (Лифшиц и др., 1998).
Приведенные выше закономерности, лимитирующие диагностическое значение гиперферментемии, относятся практически ко всем ферментам.
Повышение активности лактатдегидрогеназы более неспецифично по сравнению с аспартатдегидрогеназой, поскольку это фермент присутствует в большом количестве в эритроцитах, лейкоцитах, головном мозгу, легких, сердце, печени, поджелудочной железе, селезенке, в плазме крови больных с аортальным стенозом или протезированными клапанами сердца (вследствие внутрисосудистого гемолиза). Гиперферментемия обнаруживается примерно у 85% больных с крупноочаговым острым инфарктом миокарда. Кривая активности ЛДГ несколько отстает от АсАТ: подъем наступает в течение 2-х суток болезни, максимум активности – на 3-6-й день, показатели возвращаются к норме к концу 2-й недели. Эта особенность используется для диагностики инфаркта миокарда у больных, обратившихся к врачу спустя двое суток и более после приступа. Наряду с упоминавшимися выше причинами гиперферментемии, повышенная активность ферментов наблюдается также при тяжелых интоксикациях.
Современная клиническая биохимия характеризуется широким применением методов определения активности ферментов в биологических жидкостях и тканях. Это позволяет понять механизм возникновения многих заболеваний и предложить доступные и надежные методы для дифференциальной диагностики (Николаев, 2001).
В основе многих болезней лежат нарушения нормального функционирования ферментативных процессов (Апросина, 1996).
Любая патология с современных позиций считается ферментопатологией, поэтому определению ферментов и их изоформ придают большое значение (Циркина, 1992).
При изучении активности ферментов в клинико-диагностических лабораториях, наиболее часто исследуют активность аминотрансфераз, которые имеют принципиальное значение при процессе метаболизма животного и растительного организма, являясь связующим звеном взаимопревращения белков и углеводов (Титов и др., 1990).
Реакции трансаминирования чрезвычайно широко распространены в животных тканях, у микроорганизмов и растений. Впервые реакции трансаминирования были открыты А.Е. Браунштейном и М.Г.Крицманом в 1937 году при изучении дезаминирования глутаминовой кислоты в мышечной ткани. Реакции трансаминирования являются обратимыми и универсальными для всех живых организмов. Эти реакции протекают при участии специфических ферментов – аминотрансфераз, исследование которых имеет диагностическое значение (Шерлок и др., 1999).
Наибольшее клиническое значение имеют исследования активности аспартат- и аланинаминотрансфераз (Шерлок и др., 1999).
Активность аспартатаминотрансфераз повышается при остром панкреатите, при инфаркте миокарда, гемолитических состояниях, миокардите, нередко при остром нефрите, заболеваниях мышц и нервной системы, изредка при инфаркте легкого, как правило при обширных ранениях (Хазанов. 1988).
Аспартат- и аланинаминотрансферазы являются внутриклеточными ферментами и их содержание в сыворотке крови здоровых людей невелико. Однако при повреждении или разрушении клеток, обогащенных данными ферментами, происходит дополнительный выброс их в кровяное русло, что приводит к повышению их активности в крови (Курбатова, 2001).
Повышение активности аминотрансфераз при инфаркте легкого наблюдается в случаях, когда заболевание сопровождается перегрузкой правой половины сердца и застоем в печени (Лифшиц и др., 1998).
Степень увеличения активности аспартатаминотрансферазы не может однозначно характеризовать тяжесть поражения миокарда. Однако с целью диагностики и контроля за течением заболевания, определение активности аспартатаминотрансферазы не уступает по своей информативности ферментам креатинкиназе или ЛДГ1 и ЛДГ2 тесту (Карпищенко и др., 1997).
Повышение активности аспартатаминотрансферазы в крови наблюдается при формах инфаркта миокарда, которые электрокардиографически выявить невозможно (Шилко, 1993).
Ряд исследователей подчеркивают прогностическую ценность определения активности аспартатаминотрансферазы при инфаркте миокарда. У больных моложе 60 лет повышение активности фермента, как правило, более значительно, чем у лиц пожилого возраста. Поэтому высокая активность фермента в сыворотке крови больных старше 60 лет является плохим прогностическим признаком (Громашевская и др., 1990).
Иногда повышение аминотрансфераз связано с приемом лекарств (Гинодман и др., 1993).
В условиях патологии исследование биохимических изменений в ликворе дает возможность глубже понять особенности процессов обмена веществ в организме и оценить тяжесть заболевания. Установлено, что активность аминотрансфераз повышается в ликворе через сутки после черепно-мозговой травмы и зависит от ее тяжести. Связано это с увеличением проницаемости мембран нервных клеток и изменением процессов энергетического обмена в мозге. У больных с ушибом головного мозга средней и легкой степени активность аминотрансфераз выше, чем у больных с сотрясением мозга (Иванов и др., 1999).
Наиболее часто активность аминотрансфераз исследуют с целью дифференциальной диагностики патологии печени. Печень относится к органам, клетки которых имеют прямой контакт как с интерстициальным, так и с внутрисосудистым пространством, к тому же проницаемость стенок капилляров в печени высока. В этих условиях, при патологии гепатоцитов, аминотрансферазы быстро оказываются в сыворотке крови (Балаховский, 1987).
При патологии гепатоцитов аланинаминотрансферазы выходят в кровь только из цитоплазмы, в том время как аспартатаминотрансферазы освобождаются как из цитоплазмы, так и из митохондрий (Титов и др., 1990).
Максимальное повышение активности аминотрансферазы происходит при остром вирусном гепатите. Причем активность аланинаминотрансферазы во всех случаях острого гепатита в крови доминирует (Зилва и др., 1988).
Снижение активности аспартат- и аланинаминотрансферазы ниже нормы встречается только при тяжелых поражениях печени, когда значительно уменьшается количество клеток, синтезирующих эти ферменты (обширный некроз, цирроз) (Майер, 1999; Савченко и др., 2001).
В этих случаях уменьшение гиперферментемии объясняется резким снижением синтеза белка и других веществ. Необходимых для выработки самих внутриклеточных ферментов (Хазанов, 1988).
Внезапное снижение очень высоких уровней трансаминаз без улучшения клинической картины. Может указывать на разрушение значительной массы ткани, так как только живые клетки могут продолжать синтез ферментов (Зилва и др., 1988).
Диагностически ценным является определение активности аспартат- и аланинаминотрансферазы одновременно и расчет коэффициента де Ритиса – АсАТ/АлАТ. В норме это коэффициент равен 1,33. при инфекционном гепатите он ниже, при инфаркте миокарда – выше (Неверов, 1990).
При дифференциальной диагностике заболеваний печени важное значение имеет так же коэффициент Шмидта – АсАТ + АлАТ/ГлДГ. Острый паренхиматозный гепатит сопровождается резким увеличением активности аланинаминотрансферазы и незначительным повышением глутаматдегидрогеназы, а при механических желтухах наоборот (Комаров и др., 1981).
Максимальное повышение активности аминотрансфераз происходит при остром вирусном гепатите. Причем активность аланинаминотрансферазы во всех случаях острого вирусного гепатита в крови доминирует (Зилва, Пэнне, 1988).
Сердечная мышца содержит незначительное количество аланинаминотрансферазы и в сыворотке крови при инфаркте миокарда, но обычно остается в пределах нормы (Неверов, 1990).
Таким образом, повышение активности сывороточной аланинаминотрансферазы (АЛТ) более специфично для поражения печени (Шерлок, Дули, 1999), а АСТ – для поражения миокарда.
Ферментативная активность аминотрансфераз в сыворотке крови имеет различия в зависимости от возраста, пола, массы тела и многих других факторов, которые могут приводить к существенным колебаниям активности отдельных ферментов и быть серьезным источником ошибок в трактовке результатов исследования. Исследования показали, что активность аминотрасфераз довольно высокая у новорожденных, затем она постепенно снижается и к пятнадцати годам достигает уровня взрослых. В старческом возрасте активность аминотрансфераз снижается, составляя около 76% активности, определяемой у людей зрелого возраста. Кроме того, активность АлАС у мужчин выше, чем у женщин (Громашевская, Касаткина, 1990).
Снижение активности аспартат- и аланинаминотрансферазы ниже нормы встречается только при тяжелых поражениях печени. Когда значительно умеьшается количество клеток, синтезирующих эти ферменты (Обширный некроз, цирроз) (Майер, 1999; Савченко, Сторожук, 2001).
Аспартатаминотрансфераза– ключевой фермент в обмене белков, объединяющий все виды обмена в клетке и поэтому самый распространенный, имеющий запас прочности и стабильный уровень (Кочкина, 1998). В животных тканях этот фермент представлен двумя изоформами: митохондриальной и цитоплазматической (Кочкин, 1997). Оба изофермента представляют собой димер полипептидных цепей с 400 аминокислотными остатками в каждой. Молекула аспартатаминотрансферазы (АсАТ) содержит два активных центра, функционирующих независимо друг от друга. Изоферменты различаются по аминокислотному составу: так N-концевой аминокислотой цитоплазматического фермента является аланин, а в митохондриальном ферменте – серин (Шерлок, Дули, 1999). Как указывалось выше, содержание АСТ в сыворотке крови здоровых людей очень невелико. Однако гиперферментемия АСТ в сыворотке крови является одним из важных показателей функциональной диагностики.
Глава II. Экспериментальная часть
II.1 Обоснование выбора объекта
В эксперимент были взяты кролики породы - шиншилла. Были использованы самцы в возрасте 5-6 месяцев с массой 2 - 2,5 кг. Они широко используются в длительных экспериментах из-за удобства многократного взятия крови (Западнюк и др., 1983). У всех животных вызывали токсическое отравление подкожным введением четыреххлористого углерода 0,4% масляного раствора в дозе 2 мл / кг.
II.2 Постановка эксперимента
Животных разделили на 4 группы:
1 группа - животные, которых после интоксикации ССЬ4не лечили.
2группа - животные, которых сразу после введении CCL 4, получали сок портулака огородного (Portulaca Oleracea) 3 раза в день перорально в дозе 2 мл на 1 кг массы.
3 группа - животные которые сразу же после введения CCL4, получали витамины: В,,В2,В6,В12,С,Е,РР внутримышечно.
4 группа - животные, получавшие сок партулака огородного и витамины
Кровь для определения активности фермента брали из краевой вены уха (Западнюк, 1983) и получали сыворотку. Для этого кровь инкубировали 30 мин при комнатной температуре, затем центрифугировали 15 мин. При 3000 об/мин.
В течении эксперимента животные содержались в условиях вивария.
Животные группы 3 и 4 ежедневно получали витамины
Bl5B2,B6,Bi2>C>E, РР.
день- В,,В2,С,Е,РР
день- В6,В2,С,Е,РР
день- В12,В2,С,Е,РР
Витамины В,,В6иВ12 одновременно вводить нельзя т.к. кобальт содержащийся в витамине В12 разрушает В, и В2.
Дозы витаминов:
В - 0,1 мл 5% раствора на 1 кг веса животного.
В 2 - 0,2 мл 1% раствора на 1 кг веса животного.
В6 - 0,1 мл 5% раствора на 1 кг веса животного.
В12- 0,1 мл (500 мкг/1 мл) на 1 кг веса животного.
РР - 0,2 мл 1% раствора на 1 кг веса животного.
С - 0,2 мл 5 % раствора на 1 кг веса животного.
Е - 0,3 мл 10% раствора на 1 кг веса животного
II.3 Методика определения активности аминотрансфераз
Активность АлАТ определяли с помощью тест-набора «Лахема».
Определение основано на измерении оптической плотности гидрозонов а -оксоглутаровой и пировиноградной кислоты в щелочной среде, возникающей при самопроизвольном декарбоксировании оксал-ацетата, обладает более высокой активностью.
Реактивы:
Субстрат АлАТ - DL-альфааланин 116 ммоль/л. 2 оксоглутарат 1,7 ммоль/л. фосфатный буфер рН 7,4 83 ммоль/л.
Реактив 2 - 2,4 динитрофенилгидрозин - р-р 1 ммоль/л в HCL 1 ммоль/л.
Раствор NaOH - 16 г/ 1л.
Раствор NaOH - 16 г/ 1л.
Физиологический раствор NaCl ( 900 мг/100 мл).
Проведение анализа.
| Отмерить (мл). | Проба | Контрольный раствор |
| Субстрат АлАТ Физиологический р-р. | 0,25 | 0,25 0,05 |
| Инкубация точно 3 мин. при т-ре 37°С | ||
| Сыворотка крови | 0,05 | - |
| Инкубация точно 60 мин. при т-ре 37°С | ||
| Реактив 2. | 0,25 | 0,25 |
| Инкубация 20 мин при комнатной температуре. | ||
| Раствор NaOH | 2,50 | 2,50 |
Перемешивают и спустя 10 мин. измеряют оптическую плотность пробы против контрольного раствора. Измерение проводят на СФ - 46 при длине волны 530 нм.
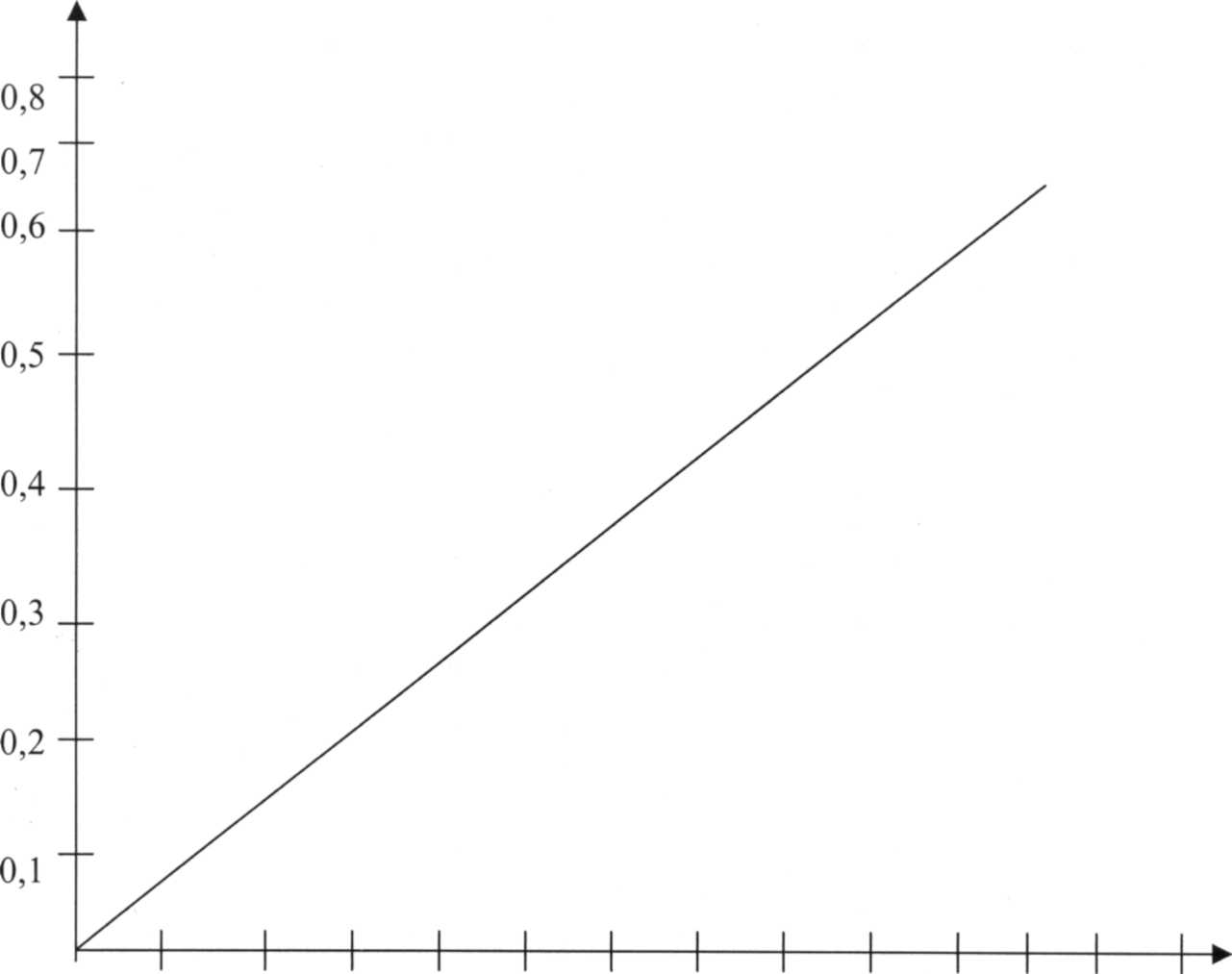 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8 0,9 1,0 1,1 1,2 1,3
0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8 0,9 1,0 1,1 1,2 1,30,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8 0,9 1,0 1,1 1,2 1,3
Калибровочный график (СФ - 46Д = 530).
Глава 3. Результаты и их обсуждение
Ферментативная активность АлАТ в сыворотке крови кроликов при однократном введении CCL4 представлена на рис. 1. Из рисунка видно, на следующий день после введения CCL4 наблюдается повышение активности фермента в 2 раза по сравнению с нормой. Дальнейшее повышение отмечается и на 2-ые сутки, хотя и незначительное. Эти результаты согласуются с литературными данными.
При токсическом поражении печени CCL4 b эксперименте на животных отмечено значительное повышение активности сыворочных аминотрансфераз. (Иванова-Тихвинская, 1968).
Увеличение активности аминотрансфераз в сыворотке крови кроликов связывают с тем, что свободный радикал CCL3, образующийся при распаде CCL4, приводит к перекисному окислению липидов мембран. В результате этого увеличивается проницаемость мембран (Лужникова, 1994) и аминотрансферазы из поврежденных клеток "вымываются" в кровь и их активность в сыворотке резко возрастает (Березов, 1998).
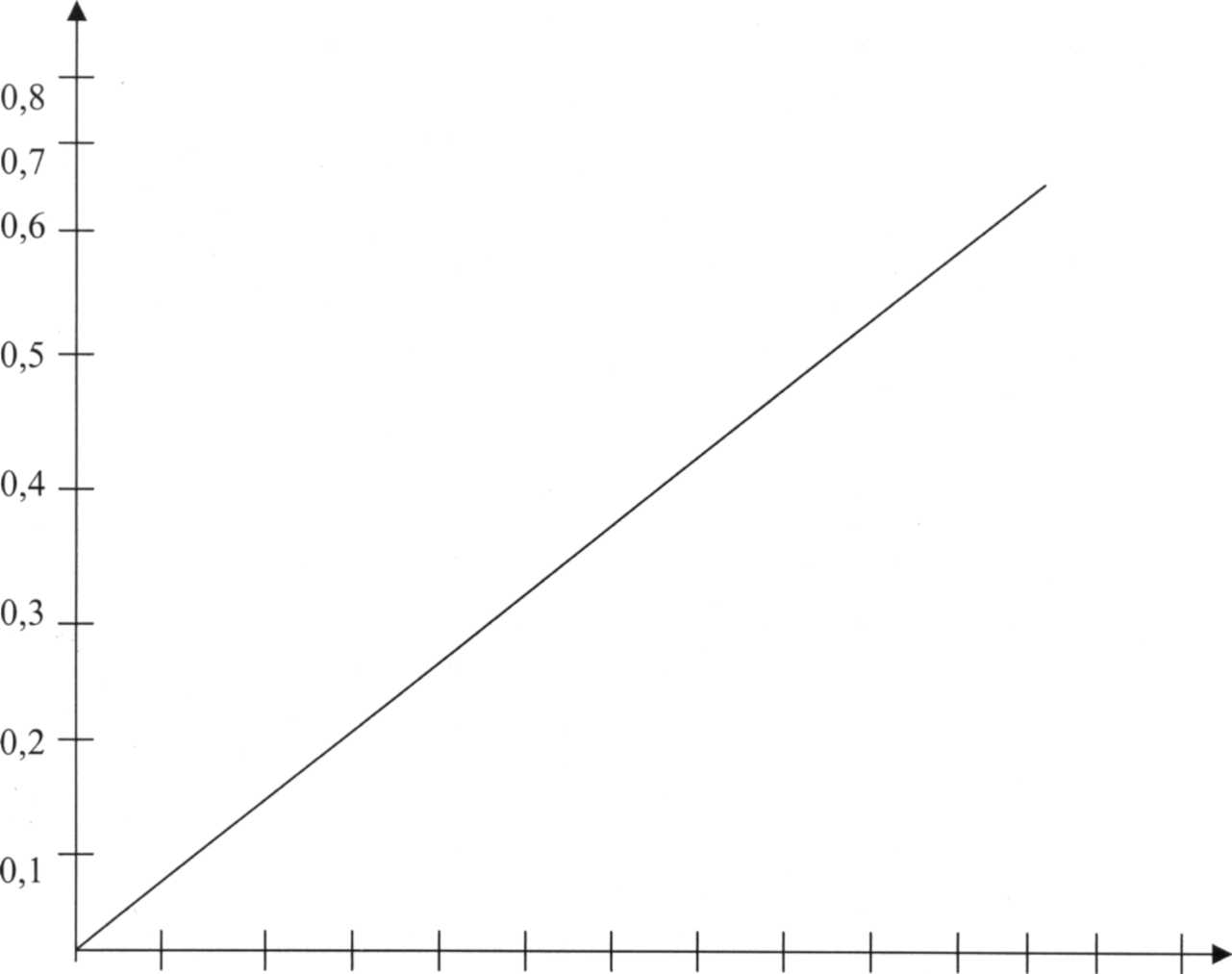
Рис 1. Изменение активности фермента АлАТ в сыворотке крови кроликов при однократном введении CCL4 без лечения.
На 3 - 5 сутки после токсического поражения в активности АлАТ сыворотки крови наблюдается небольшой спад, который все же остается выше, соответствующих значений в норме.
Пик активности АлАТ в сыворотке крови животных с токсическим поражением печени CCL 4 приходится на 2 и 7 сутки эксперимента.
На 10 день эксперимента в сыворотке крови кроликов, которых не лечили, активность АлАТ все еще выше нормы в 1,5 раза. Таким образом, при токсическом поражении печени CCL4 в дозе 2 мл/кг веса активность АлАТ в сыворотке крови на 10 сутки после отравления, без лечения не восстанавливается.
Традиционным методом лечения при токсических поражениях печени является витаминотерапия (Западнюк, 1983).
Результаты наших исследований активности АлАТ в сыворотке крови животных, которые получали витамины, для восстановления функциональной деятельности печени показаны на рис. 2.
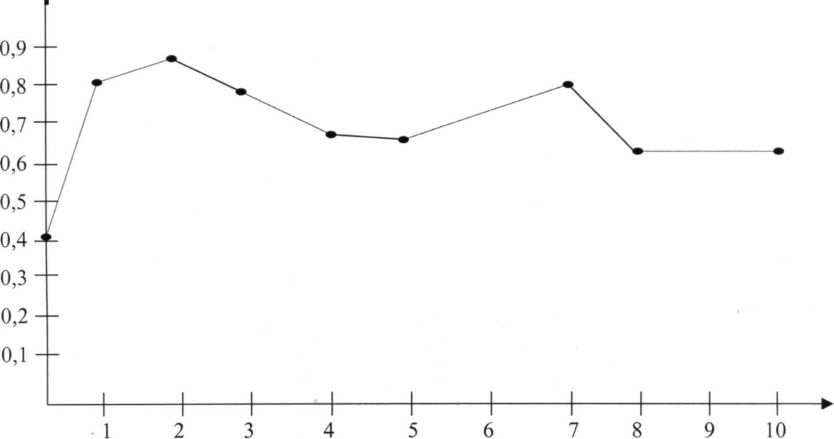
Рис 2. Динамика изменения активности АлАТ в сыворотке крови кроликов при лечении витаминами после однократного введения CCL4.
В 1 - 2 сутки токсического поражения печени активность фермента повышается в 2,5 раза. К 3 дню идет небольшое снижение активности фермента, но к 4 суткам активность АлАТ повышается до уровня активности фермента на 2-ые сутки. С 5 дня эксперимента идёт постепенное снижение активности фермента и к 10 дню активность АлАТ восстанавливается.
Сопоставление графиков на рис. 1 и 2 дает основание утверждать, что витаминотерапия является довольно эффективным способом для восстановления активности фермента, служащего тестом состояния печеночной ткани, а значит и её функциональной активности. Общеизвестно, что гепатопротекторные свойства витаминов связаны с их участием в регулярных процессах.
Витамины группы В, а также витамины А и С повышают общую реактивность организма, регулируют функциональное состояние ЦНС, обмен веществ и трофику тканей, повышают иммунитет, стимулируя выработку антител и нейтрализацию токсического действия возбудителя, усиливают фагоцитоз и защитные свойства эпителия (Маркова и др., 1979).
Обмен большинства витаминов комплекса В непосредственно связан с функцией печени. Многие из них входят в состав коферментов. Функции ферментов связаны, в частности, с присутствием в ткани тиамина, депонируемого в форме карбоксилазы и участвующего в декарбоксилировании ос-кетокислот. Витамин В2 (рибофлавин) активно участвует в окислительном дезаминировании аминокислот (Подымова, 1993).
Известно, что витамин Е (остокоферол) обладает антиоксидантным свойством. Он тормозит накопление диеновых конъюгантов и малонового диальдегида сохраняет ненасыщенные связи жирных кислот, повышает содержание восстановленного глутатиона подавлял ПОЛ он тормозит образование свободных радикалов и продуктов ПОЛ в гепатоцитах и связанное с этим нарушение проницаемости клеточных мембран при экспериментальной патологии печени, вызванной CCL4 (Георгиевский, 1990, Венгеровский и др., 1988).
Клиническое проявление антиоксидантного действия витамина Е при экспериментальных интоксикациях служат уменьшение числа погибших гепатоцитов, нормализация активности аминотрансфераз, щелочной фосфотазы и сорбитологических ферментов кислой фосфотазы и Р-глюкуронидазы (Скакун, Ковальчук, 1987).
Очень многие растения являются богатыми источниками витаминов. И ещё со времен Гиппократа в качестве пищевой добавки и в лечебных целях использовался портулак огородный (Portulaca Oleracea) - однолетнее растение с сочным стеблем и листьями, которые и использовались для получения сока и экстрактов. Это растение очень богато витаминами. В листьях и стеблях портулака огородного содержатся до 300 мг % витамина С, витамина В,, В 2 ,Е, РР и К (Молчанов и др., 1989).
Не менее важно содержание в портулаке и других органических и минеральных веществ. В нем содержатся: 0,5% жиров, белки, 0,29-0, 75% углеводов (глюкоза, галактоза, фруктоза, сахароза, мальтоза, рафиноза) (Молчанов и др. 1989, Лавренов и др. 1999), органические кислоты (янтарная, лимонная), алколоиды, гликозиды, сапонины, депамин, биофлавоноид ликвиритин, норадреналин, фенолкарбоновые кислоты (коричная, феруловая, синановая) минеральные вещества, терпеноиды (глютатион, 3-амирин, бутироспериол, паркеол, циклоартенол), стероиды (ситостерин, кампестерин, стигмастерин), смолистые и слизистые вещества, клетчатку (Буданцев 1996, Турова и др., 1987).
Учитывая такой богатый состав органических и минеральных веществ играющих существенную роль в клеточном метаболизме можно было ожидать значительное ускорение процесса регенерации печеночной ткани после отравления.
Полученные нами результаты по использованию сока портулака огородного для лечения токсического поражения печени представлены на рис. 3. В первые сутки токсического поражения активность АлАТ в сыворотке крови возрастает в 2 раза по сравнению с нормой. Максимальное повышение активности АлАТ наблюдается на 2 сутки - в 2,8 раза. Второй пик активности АлАТ приходится на 4 сутки эксперимента. С 4 дня эксперимента на 5 день активность фермента снижается в 1,5 раза, с 5 - 9 дни идет медленное снижение активности фермента и к концу эксперимента активность АлАТ восстанавливается.
Сопоставление картины восстановления активности фермента при лечении витаминами и портулаком огородным (рис. 2 и 3) дает основание полагать, что хотя в первые сутки лечения портулаком отмечается более значительный подъем активности АлАТ по сравнению с витаминотерапией, в последующие дни (начиная с 5 дня) она снижается. Снижение активности АлАТ, как показателя улучшения состояния печеночной ткани при лечении портулаком идет более равномерно и плавно.
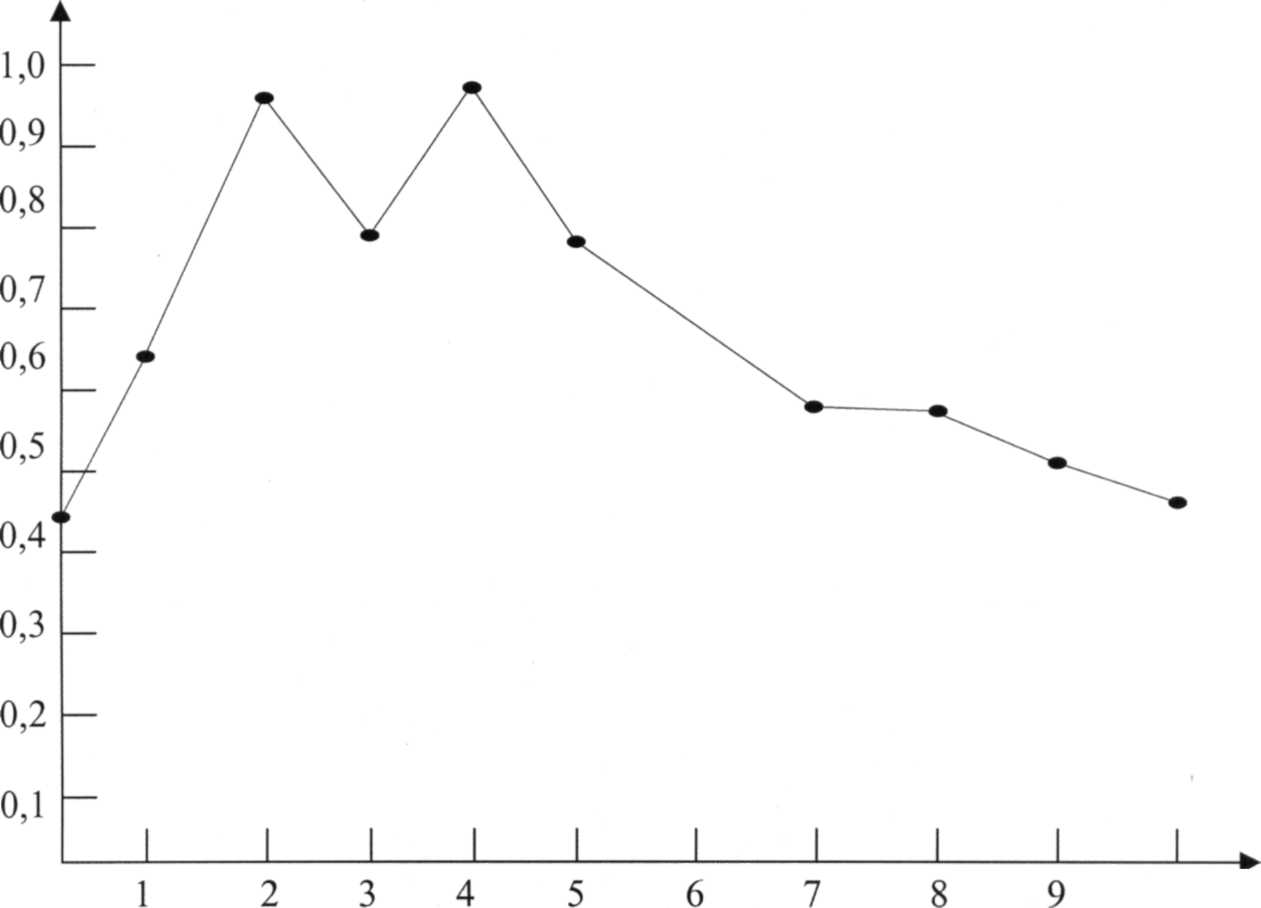
Рис 3. Динамика изменения активности АлАТ в сыворотке крови кроликов при лечении портулаком огородным.
Видимо, в процессе восстановления, наряду с витаминами существенный вклад вносят и другие соединения входящие в состав сока портулака.
Так, например, известно, что выраженным желчегонным и гепатопротекторным действием обладают фенольные соединения растительных препаратов, которые преду-преждают нарушение структуры и функции печени при различных патологических со-стояниях, ускоряют регенерацию и восстановление высокой функциональной активности гепатоцитов (Убашеев, 1980).
Экспериментально было выявлено, что оксикоричные кислоты и их гидрированные производные по антиоксидантным свойствам оказались активнее витамина Ев 1,5-2 раза, не уступали ему по желчегонному и гепатозащитному действию (Сальникова и др., 1989).
В следующей серии мы исследовали совместное действие витаминов и сока портулака на восстановление активности АлАТ после токсического поражения. Из полученных данных, приведенных на рис. 4, видно что на 2-ые сутки, сохраняется пик активности АлАТ как и при других вариантах исследования, однако он менее выражен и после 2 дня уже на 3-ие сутки отмечают спад ферментативной активности и к пятому дню уровень его соответствует контрольным значениям (0,41).
Таким образом, на ускорение процесса восстановления активности АлАТ, а значит и на регенерацию печеночной ткани после отравления четыреххлористым углеродом, значительное влияние оказывает соединения входящие в состав растительного экстракта - портулака огородного. На ряду с витаминами, концентрация которых значительно возрастает, возможно, существенный вклад вносят оксикоричные кислоты, обладающие как антиоксидантными свойствами, так и желчегонным и гепатопротекторным действием. Исследование влияние оксикоричных кислот на активность АлАТ в сыворотке крови после токсического поражения CCL 4 может быть задачей дальнейших исследований.
Таблица 1
Активность АлАТ в сыворотке крови кроликов после однократного введения CCI4 и различных вариантов лечения
(в мкмоль/л., 60 мин. инкубации)
| Норма | Контроль (отравление) п = 4 | Лечение портулаком п = 6 | Лечение витаминами п = 4 | Лечение портулаком и витаминами п = 7 | |
| 3 ч | 0,41 ±0,02 | 0,41 ± 0,003 | 0,44 ± 0,02 | 0,43 ±0,016 | 0,42 ± 0,007 |
| 1 | 0,80 ± 0,06 * | 0,90 ± 0,008' | 0,62 ± 0,06 | 0,74 ± 0,02 * | |
| день | |||||
| 2 | 0,85 ±0,04* | 1,17 ±0,06* | 0,93 ± 0,02 * | 0,78 ± 0,03 | |
| день | |||||
| 3 | 0,77 ± 0,04 | 1,0 ± 0,08 х- | 0,78 ± 0,007 | 0,69 ± 0,02 | |
| день | |||||
| 4 | 0,68 ± 0,04 | 1,1 ±0,01* | 0,94 ±0,01* | 0,58 ± 0,03 | |
| день | |||||
| 5 | 0,66 ± 0,06 | 0,65 ±0,01 | 0,74 ± 0,02 | 0,46 ± 0,005 < | |
| день | • | ||||
| 7 | * 0,83 ± 0,04 " | 0,55 ± 0,03 | 0,57 ± 0,02 | 0,49 ± 0,02 , | |
| день | |||||
| 8 | 0,64 ± 0,03 | 0,48 ±0,04 • | 0,56 ± 0,05 | 0,43 ± 0,02 > | |
| день | |||||
| 9 | 0,64 ± 0,03 | 0,45 ±0,009 ' | 0,49 ± 0,02 ' | 0,41 ±0,02 • | |
| день | |||||
| 10 | 0,64 ± 0,03 | 0,44 ±0,03 ' | 0,41 ± 0,003 . | 0,41 ± 0,02 ' | |
| день |
Примечание:
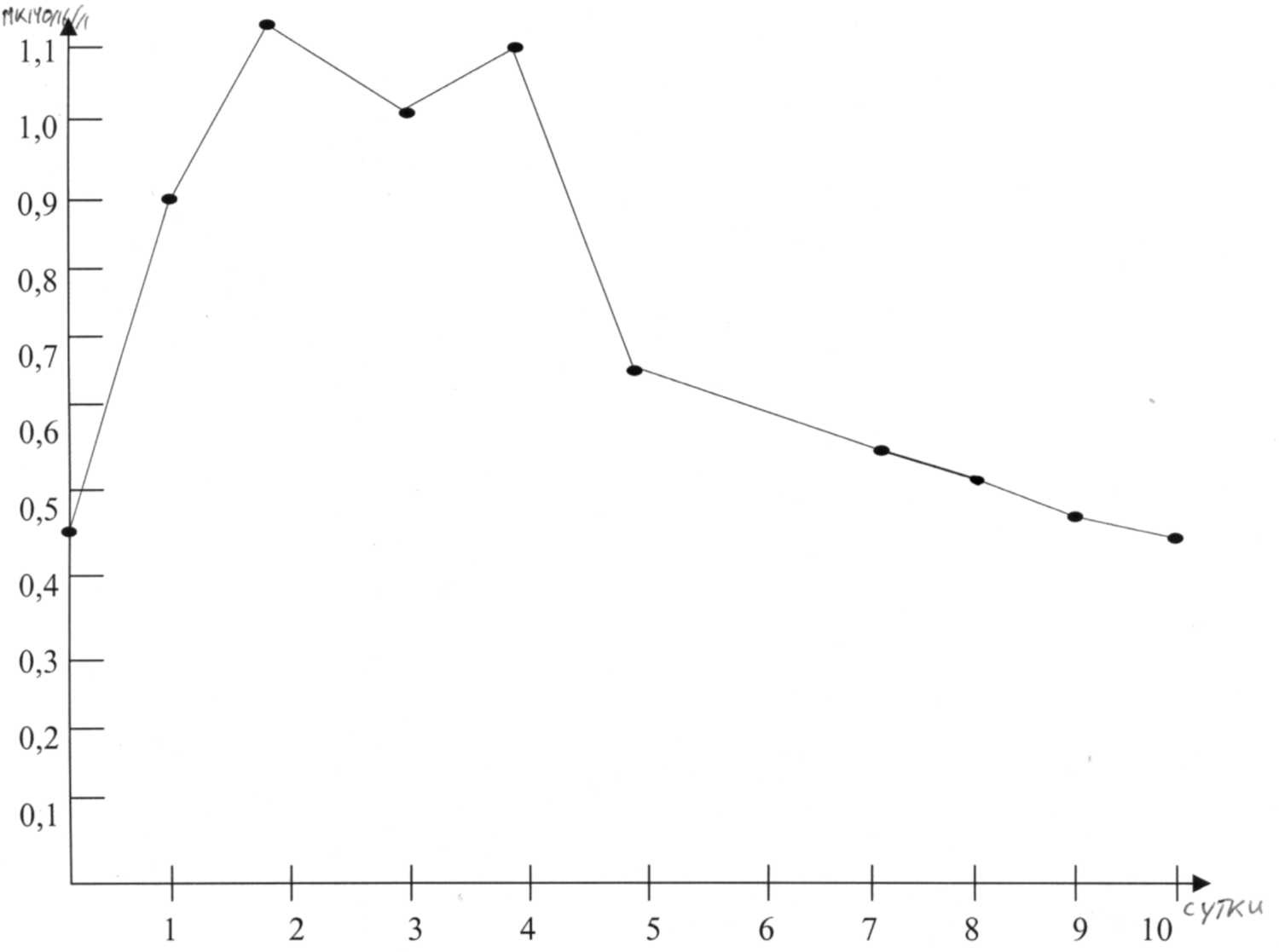
Рис 4. Восстановление ферментной активности АлАТ в сыворотке крови кроликов при лечении портулаком огородным и витаминами.
Выводы:
После токсического поражения CCL 4 активность аланинаминотрансферазы в сыворотке крови к 10 дню не восстанавливается.
Лечение комплексом витаминов приводит к восстановлению активности аланинаминотрансферазы в сыворотке крови после токсического поражения CCL4 до нормы на 9 день.
Пероральное введение сока портулака огородного (2 мг/кг веса) восстанавливает активность аланинаминотрансферазы в сыворотке крови на 9 день после отравления.
Совместное использование витаминотерапии и сока портулака восстанавливает активность аланинаминотрасферазы в сыворотке крови отравленных CCL4 животных на 5 день эксперимента.
Список литературы
Абдуллаев Н.Х., Каримов Х.Я. Печень при интоксикации гепатотропными ядами. 1989, М: Медицина -96 с.
Анцупов Т.П., Растения тибетской медицины. Опыт фармакологического исследования. Новосибирск: Наука. 1989, -205с.
Березов И.Л., Коровкин Б.Ф. Биологическая химия. М: Медицина. 1989.-704 с.
Бондарева Л.А., НемоваН.Н., Кяйвяряйнен Е.И. Внутриклеточная кальций-зависимая протеолитическая система животных. М: Наука. 2006.- 294 с.
Блинков И.Л. Лекарственные растения в клинике. М: Знание. 1983. -64 с.
Блюгер А.Ф. Основы гепатологии. Рига: Звайзгне. 1975, - 470 с.
Блюгер З.А., Новицкий И.Н. Практическая гепатология. Рига: Звайзгне. 1984,-283 с.
Буданцев А.Л. Растительные ресурсы России и сопредельных государств. С - П: Мир и семья. - 95, 1996, - 470 с.
Букин В.Н. Биохимия витаминов. М: Наука. 1982, - 320 с.
Вакулин Г.М. Ранние посттоксические дефекты в мембранах гепатоцитов, выявляемые электронно-микроскопически с помощью лантанного трансмембранного трейсера // Бюл. экспер. биол. и мед. 1989, т. 107 №1, с. 99-101.
Венгеровский И.И., Саратиков А.С. Механизм действия гепатопротекторов при токсических поражениях печени // Фармак. итоксикол. 1988, Т. 51№1,с. 99- 101.
Вилкенсон Д. Принципы и методы диагностической энзимологии. М: Медицина. 1981,-624 с.
Виноградова Ф, Харицкая Е., Мирзаян Ж. Антиоксидантная активность убихинона - 9 и его комбинация с витамином Е и селенитом натрия при токсическом поражении печени. // Фармак. и токсикол. 1989, ТЛИ. №53, с. 53 - 56.
Георгиевский В.П. Биологически активные вещества лекарственных растений. Новосибирск: Наука, Сибирское отделение. 1990, - 247 с.
Дубинина Е.Е. Продукты метаболизма кислорода в функциональной активности клеток. Санкт-Петербург Мед. Пресса .2006, - 298 с.
Западнюк И.П., Западнюк В.И. Западнюк Б.В., Захария Е.А. Лабораторные животные. Разведение, содержание, исследования в эксперименте. Киев: Вища школа. 1983, - 383 с.
Иванова - Тихвинская Е.Л. К вопросу о токсическом поражении печени // Терапевтический архив. Т 40, Вып. 3, 1968, с. 20 - 26.
Зимин В.М. Библиотека лекарственных растений. С - П: АО «Дорваль». 1992. 265 с.
Колпаков М.А., Грек Ю.В., Башкирова О.Р., Любарский М.С., Равилова Ю.Р. Гепатопротекторные свойства водного экстракта пятилистника кустарникового при хроническом токсическом гепатите // Бюлл. экспер. биол. и мед. 2001, т. 131. №5, с. 620-625.
Ковлер М.А., Павленко А.А., Курганов Б.И, Авакум В.И. Влияние пиридоксальфосфата на активность АлАТ в сыворотке крови кроликов при токсическом гепатите // Химфарм журн.. 1986. - №5, с. 522 - 524.
Куница Н.И., Кузьменко И.В., Алексеев СМ., Захарова Е.И. Участие токоферола и его аналогов в процессах перекисного окисления липидов и транспорта электронов в митохондриях крыс in vivo. //Биохимия. 1993, т. 58., в. 11. с. 1709- 1713.
Лавренов В.Н., Лавренова Г.В. Полная энциклопедия лекарственных растений. С - П: Нева. 1999, - 815 с.
Лужников Е.А. Клиническая токсикология. М: Медицина. 1994, -254 с.
Лужников Е.А., Костомаров Л.Г. Острые отравления: руководства для врачей. М: Медицина. 1989, - 432 с.
Лужников Е.А., Шиманко ИИ, Ишмухаметов Т.В., Новиковская Т.И., Ильицкая А.И. Особенности лечения токсического поражения печени при острых экзогенных отравлениях // Современная медицина. 1980, №, с. 20 - 26.
Маркова Н.В., Салеев В.Н., Утешев Б.С. Фармакология. М: Медицина. 1979, - 584 с.
Махлюк П.В. Лекарственные растения в народной медицине. Саратов: Приволжское книжное издательство. 1993, - 544 с.
Молчанов Г.И., Сучков И.Ф. Съедобные растения Кавказа: Справочник. Ростов-на-Дону: 1996, - 470 с.
Надиров Н.К. Токоферолы (витамины группы Е) - биологически активные вещества. М: Знание. 1981, - 64 с.
Овчинников Ю.А. Биоорганическая химия. М: Просвещение. 1987, -815 с.
Подобед О.В., Федорова Л.М., Якушева И.В., Авакумова О.Ю. Влияние фосфотидилхолина на репарационные процессы в клетках печени при её остром поражении CCL4 // Вопросы мед. химии. 1995, №5, с. 13-16.
Подымова С.Д. Болезни печени: Руководство для врачей. М: Медицина. 1993, 544 с.
Проскурякова И.С. Морфофункциональные аспекты регенерации печени при экспериментальной коррекции токсического гепатита. // Бюл. Экспер. Биол. и мед. 1995, №6, с.656 - 659.
Прокопенко А.И., Конопля А.И. Химическая природа и функциональная активность иммуномодилирующих факторов сыворотки крови при токсическом поражении печени. // Журнал микробиологии, эпидемиологии, иммунологии. 1978, №2, с. 36 -40.
Рапопорт СМ. Медицинская биохимия. М: Медицина, 1966, 872 с.
Сальникова СИ., Дроговоз СМ., Слышков В.В., Гужва Н.Н., Гепатозащитная активность аналогов коричной кислоты. // Фармакология и токсикология, 1989, Т. 52, №3. с. 77 - 80.
Северин Е.С. Биохимия. М: ГЭОТАР-МЕД, 2003, 780 с.
Скакун Н.П., Ковальчук С.Ф. Эффективность антиоксидантов при комбинированном поражении печени четыреххлористым углеродом и этанолом. // Фармакология и токсикология. 1987. №3., с. 97-99.
Турова А.Д., Сапожникова., Вьен Дыок Ли. Лекарственные растения СССР и Вьетнама. М: Медицина. 1987. - 400 с.
Хныченко Л.К., Бульон В.В., Заводская И.С. Сапронов И.С., Гапонова Л.В. Гепатозащитные свойства белков сои и возможность их использования в диетотерапии хронического токсического гепатита. // Бюл. экспер. биол. и мед. 2000., т . 129. №4, с. 283 -285.
Шерлок Ш., Дули Дж. Заболевание печени и желчных путей. М: ГЭОТАР. Медицина. 1999, 860 с.
Шкурупий А.В. Количественное исследование ультраструктурной организации гепатоцитов печени интактных мышей и в условиях острого отравления CCL4. // Бюллетень экспериментальной биологии и медицины. 1973, т. 45, №2, с. 110-113.
Убашеев И.О., Коншакова К.С, Матаханов Э.И., Цыренжапова О.Д. Зубчатка поздняя как стимулятор восстановительных процессов в печени крыс при хроническом токсическом гепатите. // Химикофармакологический журнал. 1980, №5, с. 518-521.
Якушева Е.Н. Баланс электролитов и катехолагинов в ткани кровеносных сосудов при экспериментальном токсическом гепатите и его фармакотерапии. // Патологическая физиология и экспериментальная терапия. М: Медицина. 1991. №5. С. 27 - 29.
Якушева Е.Н. Влияние аевита и рибофлавина на баланс электролитов в стенке печеночных кровеносных сосудов при экспериментальном токсическом гепатите. // Фармакология и токсикология. 1986, Т. 49, №2, с. 71 - 74.
46. Fever J, Vereckei, Leaguel G. Role of free - radical reaction in liver diseases: [Pap] 3-rd. Sump. // Asto physiol hyg - 1993. №1 - 4. c.351 -361.
